Архив документов
Современные принципы лечения паркинсонизма
В.Н. Шток, Н.В. Федорова
Российская медицинская академия последипломного образования, Центр экстрапирамидных заболеваний нервной системы Минздрава РФ, Клиническая больница им. С.П.Боткина
Паркинсонизм
– синдром поражения
экстрапирамидной системы,
патогенез которого связан с
прогрессирующей дегенерацией
нигростриарных нейронов, в
результате чего снижаются синтез
дофамина и активность
дофаминергических систем,
активность же холинергических
относительно или абсолютно
повышается. В качестве
противопаркинсонических средств
применяют холинолитические
препараты, производные
аминоадамантана, ДОФА-содержащие
средства, ингибиторы
моноаминоксидазы типа Б,
ингибиторы
катехол-О-метилтрансферазы и
агонисты дофаминовых рецепторов.
При значительном одностороннем
преобладании тремора и ригидности,
не поддающихся фармакотерапии, а
также при выраженных побочных
реакциях на фоне последней
прибегают к стереотоксическим
деструктивным операциям.
Определенные перспективы
открывает внутримозговая
трансплантация дофаминергических
нейронов мезенцефалона
человеческого эмбриона.
Паркинсонизм – синдром
поражения экстрапирамидной
нервной системы, характеризующийся
сочетанием дрожания,
экстрапирамидной мышечной
ригидности с симптомом “зубчатого
колеса” и акинезии. По мере
прогрессирования болезни
появляется и четвертый симптом –
постуральная неустойчивость.
Различают болезнь Паркинсона,
вторичный паркинсонизм
(сосудистый, лекарственный,
посттравматический,
постэнцефалитический и др.) и
синдром паркинсонизма при
дегенеративных и наследственных
заболеваниях ЦНС (стрионигральная
дегенерация, прогрессирующий
супрануклеарный паралич,
оливопонтоцеребеллярная атрофия,
идиопатическая ортостатическая
гипотония, болезни Альцгеймера и
Пика, гепатоцеребральная
дегенерация, хорея Гентингтона,
семейная кальцификация базальных
ганглиев и др.). Несмотря на
различную этиологию этих
заболеваний, патогенез клинических
симптомов сходен и связан с
прогрессирующей дегенерацией
нигростриарных нейронов, в
результате чего снижаются синтез
дофамина и активность
дофаминергических систем,
активность же холинергических
относительно или абсолютно
повышается. Все основные подходы к
фармакотерапии паркинсонизма
направлены на коррекцию этого
дисбаланса нейромедиаторов,
обеспечивающих деятельность
экстрапирамидной нервной системы.
Таблица
1. Антихолинергические препараты и
производные аминоадамантана
| Антихолинергические
средства |
Содержание
активного вещества в 1
таблетке, г |
Производные
аминоадамантана |
Содержание
активного вещества в 1
таблетке, г |
| Тригексифенидил
|
0,001 – 0,002 – 0,005 |
Амантадина
гидрохлорид |
0,1 |
| Бипериден
|
0,002 |
Мидантана
глюкуронид |
0,2 |
| Трипериден |
0,002 |
|
| Бенактизина |
0,002 |
| Arpenaium |
0,05 |
| Aprophenum |
0,025 |
Противопаркинсонические
средства (ППС)
Для
фармакотерапии паркинсонизма
применяют холинолитические
средства, производные
аминоадамантана, ДОФА-содержащие
средства (ДСС), ингибиторы
моноаминоксидазы (МАО) типа Б,
ингибиторы
катехол-О-метилтрансферазы (КОМТ) и
агонисты дофаминовых рецепторов
(АДР).
Индивидуальная
чувствительность к ППС
вариабельна. Порог эффекта ППС
определяется минимальной дозой
одного ППС, которая уменьшает
проявления паркинсонизма. Все ППС
могут давать побочные эффекты.
Порог побочного действия
определяется дозой препарата,
вызывающей побочные реакции.
“Промежуток” между этими порогами
определяет границы
фармакотерапевтического окна, или
величину оптимальной
индивидуальной дозы каждого ППС.
Общим правилом
при назначении любого ППС является
начало лечения с субэффективной
дозы и последующее очень медленное
ее наращивание (в среднем в течение
1 – 1,5 мес) для выбора дозы, дающей
минимальный эффект (доза порога
эффекта).
Необходимость такого подхода
объясняется тем, что по мере
прогрессирования болезни доза
порога эффекта повышается, а порог
дозы, вызывающей побочные реакции,
снижается, то есть суживаются границы
фармакотерапевтического окна.
Таблица
2. ДОФА-содержащие препараты
| I. Препараты,
содержащие только леводопу |
| Levodopa |
1 таблетка/капсула
– 0,25 или 0,5 г |
Максимальная
суточная доза – 3,0 г |
| II. Препараты,
содержащие леводопу в
комбинации с ингибитором
периферической ДДК |
| Препарат |
Содержание
леводопы, мг |
Содержание
ингибитора, мг |
Леводопа/ингибитор
ДДК |
Максимальная
суточная доза, мг(таблеток) |
| Таблетки: |
| синемет наком |
250
|
25
|
10 : 1
|
750 (3)
|
| Капсулы: |
| мадопар-125 |
100
|
25
|
4 : 1
|
7
капсул
|
| мадопар-250 |
200
|
50
|
4 : 1
|
3
капсулы
|
| Таблетки: |
| Tidomet LS |
100
|
10
|
10 : 1
|
700 (7)
|
| Tidomet Plus |
100
|
25
|
1 : 1
|
700 (7)
|
| Tidomet Forte |
250
|
25
|
10 : 1
|
750 (3)
|
| III. Препараты
пролонгированного действия,
содержащие леводопу и
ингибитор ДДК |
| Капсулы: |
| Мадопар HBS |
100
|
25
|
4 : 1900 (9)
|
| Таблетки: |
| синемет CR |
200
|
50
|
4 : 1900 (4, 5)
|
| наком R |
200
|
50
|
4 : 1900 (4, 5)
|
Лечение
холинолитическими препаратами
Холинолитические
средства при паркинсонизме
купируют относительное или
абсолютное повышение активности
холинергических систем. Несмотря
на то, что различные препараты этой
группы являются аналогами (табл. 1), на практике нередко
отмечается преимущественная
индивидуальная чувствительность
больных к одному из них. С целью
выявления индивидуальной
чувствительности в начале лечения
каждые 3 – 4 мес один
холинолитический препарат
заменяют другим. В дальнейшем
наиболее эффективный препарат
назначают для постоянного приема с
заменой его 1 – 2 раза в год на срок 1
мес другим холинолитическим
препаратом, чтобы избежать
возможного привыкания. Если
возникают сомнения в эффективности
холинолитического препарата, его
отменяют. Ухудшение симптомов
паркинсонизма после внезапной
отмены свидетельствует о том, что
назначенное лечение было
эффективным, и тогда прием
препаратов возобновляют.
Холинолитические средства
противопоказаны при глаукоме и
аденоме предстательной железы.
Побочные явления в виде сухости во
рту, затуманивания зрения
свидетельствуют об индивидуальной
передозировке и требуют коррекции
однократной и суточной дозы.
В связи с неблагоприятным
влиянием на когнитивные функции
лечение холинолитическими
средствами не начинают в пожилом и
старческом возрасте, а также у
больных с деменцией.
Таблица
3. Ингибиторы МАО типа B и ингибиторы
КОМТ
Препараты
|
Доза,
мг/сут
|
обычная
|
максимальная
|
| Ингибиторы
МАО типа B: |
| Селегилин
(таблетки по 5 мг) |
10 – 15
|
40
|
| Ингибиторы
КОМТ: |
| Tolcapon |
100 –
200
|
400
|
| Entacapon |
200 –
800
|
2000
|
Таблица
4. Агонисты дофаминовых рецепторов
| Препараты |
Содержание
активного вещества,
мг |
Суточная
доза, мг |
| Bromocriptin: |
| таблетки |
2,5
|
15 – 25
|
| капсулы |
5 или 10
|
|
| Pinbedil,
таблетки |
0,025
|
2,5
|
| Lisuride,
таблетки |
0,025
|
2,5
|
| Pergolide,
таблетки |
0,05,
0,25, 1
|
0,75 – 5
|
Лечение
производными аминоадамантана
Препараты
этого класса обладают
холинолитическими свойствами и
улучшают кругооборот дофамина в
дофаминергических синапсах.
Аналоги амантадина гидрохлорида (см. табл. 1) назначают 2 – 3 раза в
день по 1 таблетке (0,1 г). Чаще эти
препараты добавляют к
холинолитическим средствам или ДСС
при снижении их эффекта, но они
могут применяться и как средство
начальной терапии. Как правило,
сначала назначают половинную дозу
(0,05 г) 2 – 3 раза в сутки, а потом
постепенно в течение 3 – 4 нед
увеличивают ее до средней суточной
(0,3 г). Побочными эффектами при
лечении амантадином являются
беспокойство, несистемное
головокружение, появление
“мраморной” окраски кожи
дистальных отделов конечностей,
отечность голеней, зрительные
иллюзии. Глюкуронид мидантана –
глудантан (0,2 г) уступает в
фармакотерапевтической активности
амантадину гидрохлориду, но реже
дает побочные эффекты.
Рис. 2. Действие АДР на
пресинаптические дефаминовые и
постсинаптические рецепторы.
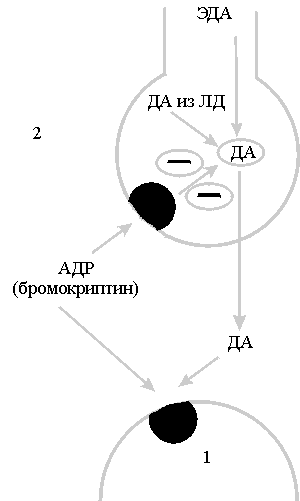
ЭДА-эндогенный дофамин;ДА из
ЛД-дофамин из принятой
леводопы;1-постсинаптический
дофаминовый
рецептор;2-пресинаптический
дофаминовый рецептор.
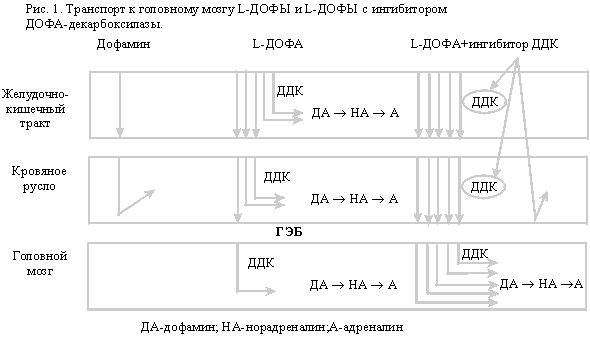
Лечение
препаратами “чистой” леводопы
Поскольку
дофамин, как и другие катехоламины,
не проходит через
гематоэнцефалический барьер (ГЭБ),
для заместительной терапии
применяют метаболический
предшественник дофамина –
леводопу (L-диоксифенилаланин),
которая проходит через ГЭБ и в
дофаминергических нейронах под
действием церебральной
ДОФА-декарбоксилазы (ДДК)
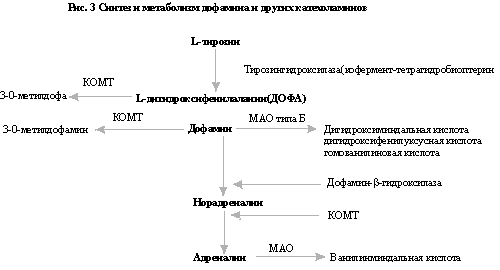
превращается в дофамин. Метаболизм
леводопы под действием ДДК и
катаболизм дофамина под действием
МАО типа В и КОМТ представлены на
схеме (рис.
3).
Препараты “чистой” леводопы (табл. 2) содержат 0,25 или 0,5 г
активного вещества. Лечение
леводопой может служить
дополнением к комбинированной
терапии холинолитическими
средствами, амантадином или АДР,
либо применяться как монотерапия в
начале лечения паркинсонизма.
Лечение начинают с субпороговой
дозы (125 мг леводопы) и постепенно, в
течение 1,5 – 2 мес, повышают дозу до
наступления эффекта. При быстром
увеличении индивидуальной дозы
возрастает риск раннего появления
побочных эффектов со стороны
желудочно-кишечного тракта и
сердечно-сосудистой системы. Это
обусловлено тем, что в
желудочно-кишечном тракте и
кровяном русле происходит
“преждевременное”
декарбоксилирование леводопы с
образованием не только дофамина, но
и норадреналина и адреналина. Это в
50 – 60% случаев приводит к появлению
тошноты, рвоты, кишечным
дискинезиям, нарушению сердечного
ритма, стенокардии и колебанию
артериального давления. Поэтому
назначение “чистой” леводопы
нежелательно при заболеваниях
желудочно-кишечного тракта,
ишемической болезни сердца с
нарушением ритма, стенокардией.
Суточная доза
леводопы не должна превышать 3 г, но
даже при длительном лечении эта
доза вызывает побочные реакции.
“Преждевременному”
декарбоксилированию подвергается
до 80% принятой внутрь леводопы и
только 1/5 часть принятой дозы
достигает головного мозга и
метаболизируется церебральной ДДК
с образованием дофамина, а также
нoрадреналина и адреналина. Если
уровень образующихся в мозге
катехоламинов превышает порог
побочного действия, то появляются
неврологические (дистонии и
дискинезии) и психические
(галлюцинации, возбуждение, бред,
спутанность) побочные реакции. Эти
проявления требуют снижения дозы, а
иногда – отмены препарата.
Лечение
препаратами леводопы в сочетании с
ингибиторами периферической ДДК
Препараты,
содержащие леводопу с ингибитором
периферической ДДК – карбидопой
или бенсеразидом, представлены в табл. 2. Ингибиторы
периферической ДДК тормозят
преждевременное
декарбоксилирование леводопы в
желудочно-кишечном тракте и
кровеносном русле (рис. 1). Соотношение
количества леводопы и ингибитора
ДДК в разных препаратах различно (см. табл. 2). Чем больше
содержание ингибитора, тем меньше
риск побочных эффектов со стороны
желудочно-кишечного тракта и
сердечно-сосудистой системы.
При приеме препаратов леводопы
с ингибитором ДДК частота
сердечно-сосудистых и
гастроэнтерологических осложнений
снижается до 4 – 6%. В то же время
торможение “преждевременного”
декарбоксилирования в 5 раз
увеличивает поступление принятой
дозы леводопы через ГЭБ в головной
мозг. Поэтому при замене “чистой”
леводопы препаратами с ингибитором
ДДК назначают в 5 раз меньшую дозу
леводопы (в пересчете на “чистую”
леводопу. Например, если больной
принимал в день 3 г “чистой” леводопы, то
количество леводопы в сутки в
составе препаратов с ингибитором
периферической ДДК должно быть в 5
раз меньше (3000 мг : 5 = 600 мг) и
составит приблизительно 2,5
таблетки накома или синемета (625 мг
леводопы), или 6 капсул мадопара-125, или 3 капсулы
мадопара-250 (600 мг леводопы).
Если препараты леводопы с
ингибитором назначаются в виде
начальной терапии, то лечение
начинают с субпороговых доз
(например, 1/4 таблетки синемета или
накома 2 раза в сутки) с постепенным
повышением дозы в
течение 3 – 5 нед.
Поскольку ингибитор
периферической ДДК не проходит
через ГЭБ и не влияет на
образование в мозге дофамина,
норадреналина и адреналина, риск
неврологических и психических
побочных симптомов остается таким
же, как и при приеме “чистой” леводопы. Поэтому
суточная доза препарата с
ингибитором ДДК в большинстве
случаев не должна превышать 750 мг
леводопы.
Применение витамина В6 в
сочетании с “чистой” леводопой
нецелесообразно, в то же время при
лечении препаратами леводопы,
содержащими ингибитор
ДДК, назначение витамина В6
возможно.
Клинический
патоморфоз паркинсонизма при
длительном течении заболевания и
лечении ДСС
При
рациональном подборе оптимальной
индивидуальной дозы выраженный
фармакотерапевтический эффект ДСС
без появления побочных реакций
сохраняется обычно в течение 4 – 7
лет, после чего даже при приеме
привычной оптимальной дозы
отмечаются разнообразные побочные
реакции и изменения типичной
клинической картины паркинсонизма
(клинический патоморфоз) с
появлением ряда феноменов.
Феномен истощения эффекта
однократной дозы обусловлен
укорочением продолжительности
действия лекарств. Эффект
препаратов значительно
уменьшается и даже исчезает через
короткие промежутки времени после
приема леводопы (например, спустя 2
– 3 ч), в результате чего
возобновляются симптомы
заболевания. Такие изменения
двигательной активности обычно
четко связаны с временем приема
лекарств и определяются как
простые моторные флюктуации.
Феномен “включение – выключение”
заключается в том, что эффект
очередной однократной дозы
леводопы спустя определенное время
после приема лекарств (30 – 60 мин)
наступает очень быстро – в течение
5 – 15 мин (“включение”)
продолжается 1 – 1,5 ч и так же быстро
исчезает (“выключение”). При
быстром включении состояние может
измениться от почти полной
обездвиженности до почти полной
раскованности. Значительные
колебания двигательной активности
в течение дня не обязательно
происходят внезапно и не всегда
четко связаны с приемом лекарств.
Эффект однократной дозы становится
недостаточным, отсроченным по
времени, а иногда очередная доза
может вообще не дать лечебного
эффекта. Такие непредсказуемые
колебания двигательной активности
называют “сложными моторными
флюктуациями”.
Феномен “застывания”
проявляется состоянием внезапной
пароксизмальной акинезии. Выделяют
акинезию начала движения
(стартовые затруднения движения),
“акинезию поворота”, “акинезию
порога”. Акинезия часто
сопровождается топтанием на месте
или постуральной нестабильностью.
Фармакологические
подходы к коррекции проявлений
моторных флюктуаций
Если
проявления клинического
патоморфоза наступают в
определенное время после приема
ДСС, то их уменьшения можно
добиться изменением кратности
приема, величины какой-либо
однократной дозы утром, днем или
вечером. Однако возможности такого
подхода ограничены.
Более эффективной оказалась
фармакологическая коррекция с
помощью ДСС пролонгированного
действия, ингибиторов МАО типа Б,
агонистов дофаминовых рецепторов.
ДСС
пролонгированного действия (ДССПД)
Технология
изготовления ДССПД обеспечивает
постепенное высвобождение, а
следовательно, и всасывание
леводопы и ингибитора ДДК из
принятой внутрь таблетки (синемет
CR, наком R) или капсулы (мадопар HBS; см. табл. 2). При приеме этих
препаратов более стабильный
уровень концентрации препарата в
крови и более равномерный синтез
дофамина из лекарств в головном
мозге позволяет уменьшить
выраженность простых и сложных
моторных флюктуаций, уменьшает
частоту и степень лекарственных
дискинезий, возникающих при приеме
ДСС непролонгированного действия.
Биодоступность синемета CR и
мадопара HBS меньше, чем
биодоступность традиционных
препаратов (синемета и мадопара).
Поэтому в случае замены
традиционных ДСС на препараты
пролонгированного действия доза
леводопы для получения прежнего
противопаркинсонического эффекта
может быть увеличена на 20 – 30%. При
приеме ДССПД кратность приема в
течение дня может быть уменьшена.
Если эти препараты применяют в
начале лечения больных
паркинсонизмом (на начальной
стадии), равномерный
фармакотерапевтический эффект
иногда удается получить при приеме
препаратов 1 – 2 раза в сутки.
Ингибиторы
МАО типа B
Ингибиторы МАО
типа B (табл.
3)
препятствуют метаболической
деградации наличного дофамина,
образовавшегося в процессе
эндогенного синтеза из
лекарственной леводопы. Благодаря
этому поддерживается более высокий
и стабильный уровень наличного
дофамина, сглаживаются проявления
феномена истощения дозы, включения
– выключения и другие проявления
моторных флюктуаций.
В большинстве случаев для
достижения указанного эффекта,
который, однако, никогда не бывает
значительно выражен, достаточно
принимать селегилин по 5 мг 2 – 3
раза в сутки. Некоторые авторы
считают необходимой дозу 40 мг/сут.
Ингибиторы
КОМТ
КОМТ в
результате естественного
метаболизма преобразует L-ДОФА в
3-0-метилдофу, а дофамин – в
3-0-метилдофамин. Эти продукты не
участвуют в осуществлении функции
дофаминовых нейронов. Ингибиторы
КОМТ препятствуют метаболизму
дофамина и его предшественника.
Ингибитором КОМТ, не проходящим ГЭБ
и поэтому метаболизирующим
леводопу на “периферии”, является
энтакапон, а ингибитором,
проходящим ГЭБ, т. е. действующим и
“на периферии”, и в головном мозге,
– толкапон (табл. 3).
Добавление толкапона к ДСС
повышает и пролонгирует стабильный
уровень леводопы в плазме на 65%.
Добавление ингибиторов КОМТ
увеличивает
фармакотерапевтическую
эффективность и корригирует
моторные флюктуации в 83% случаев
чаще, чем добавление АДР (69%
случаев).
Агонисты
дофаминовых рецепторов
В отличие от
всех упомянутых выше лекарств АДР (табл. 4) способны действовать
непосредственно на
постсинаптические дофаминовые
рецепторы “в обход”
дегенерированного
дофаминергического нейрона.
В основе корригирующего влияния
АДР на проявления клинического
патоморфоза лежит сочетание
стимулирующего действия на
постсинаптические рецепторы и
модулирующего действия на функцию
пресинаптического
дофаминергического нейрона (рис. 2).
Пирибедил (агонист как Д1, так и Д2-рецепторов) оказался
эффективнее бромокриптина (агонист
Д2-рецепторов)
при назначении в виде монотерапии и
при добавлении к ДСС.
Применение
препаратов, корригирующих
клинический патоморфоз, в качестве
средств начальной терапии
В последние
годы препараты, корригирующие
патоморфоз, предлагают применять
для начальной терапии
паркинсонизма. Тактика подбора
индивидуальной оптимальной дозы
такая же, как и для других ППС. Опыт
показывает, что по эффективности с
традиционными ДСС могут сравниться
только ДССПД. Препараты селегилина
и АДР имеют гораздо более низкий
потенциал антипаркинсонического
эффекта. Одним из оснований для
применения в качестве начальной
фармакотерапии ингибиторов МАО
типа Б является предположение о
том, что дегенерации
нигростриарных нейронов при
паркинсонизме способствует
усиление перекисного окисления
липидов. В многоцентровом
исследовании “Антиоксидантная
терапия депренилом и токоферолом
при паркинсонизме” (ДАТАТОР), в
котором применялись селегилин (10 мг
в день) и токоферол (2000 МЕ в день),
показано замедление
прогрессирования паркинсонизма.
Однако гипотезу об эффективности
антиоксидантов при лечении
паркинсонизма нельзя считать
доказанной.
Нейрохирургическое
лечение паркинсонизма
Одним из
методов лечения паркинсонизма
являются нейрохирургические
операции: стереотаксические методы
(деструкция или стимуляция
определенных структур базальных
ядер) и внутримозговая
трансплантация эмбриональной
ткани и мезенцефалона человека в
подкорковые структуры.
Показаниями к
стереотаксическим деструктивным
операциям (вентролатеральная
таламотомия, паллидотомия,
таламо-субталамотомия и др.) служат
клинические формы паркинсонизма со
значительным односторонним
преобладанием тремора и ригидности
(гемипаркинсонизм), не поддающиеся
фармакотерапии, а также наличие
побочных реакций при назначении
ППС.
Стереотаксическая стимуляция –
хроническая
электростимуляция подкорковых
структур через имплантированные
электроды – проводится с целью
торможения тремора и ригидности.
Она может комбинироваться с
вентролатеральной таламотомией.
Внутримозговая трансплантация
дофаминергических нейронов
мезенцефалона эмбриона человека
остается до настоящего времени
клинико-экспериментальной
операцией, эффективность которой
продолжает изучаться.
Имплантированные эмбриональные
нейроны мезенцефалона либо сами
продуцируют дофамин, либо
способствуют увеличению синтеза
нейротрансмиттера из леводопы,
принимаемой больным.
Внутримозговая трансплантация не
приводит к полному исчезновению
симптомов болезни, но значительно
улучшает перспективы последующей
фармакотерапии: у больных
увеличивается продолжительность
действия
однократной дозы ДСС, уменьшается
выраженность лекарственных
дискинезий, в ряде случаев удается
снизить суточную дозу ППС.
(c) Николаев С.В., 2002-2005

